En este artículo, la regla del octeto ( Regla del octeto ) Conocer las propiedades del oxígeno activo. Átomo de hidrógeno Átomo de helio Átomo de oxígeno Es fácil entender la regla del octeto como ejemplo.
¿Qué es la regla del octeto?
Fibras musculares intactas (manguito rotador del hombro del ligamento del tendón muscular) y Comportamiento extraño de los radicales libres que destruyen las células del cerebro ¿Entiendes (^^)? Para hacer eso Reglas de octetos Necesita conocer una teoría química llamada regla del octeto. Hay muchas personas que no están familiarizadas, pero no es realmente difícil escuchar la explicación ~ ^^
Reglas de octetos La (regla del octeto) es una teoría química que establece que cada átomo que constituye una molécula se encuentra en el estado más estable cuando 8 electrones entran en la capa más externa. (2 en la primera capa) Cada átomo tiene un núcleo atómico en el centro y un electrón afuera. Y el número atómico se asigna según el número de electrones.
La regla del octeto establece que cuando el electrón sigue la regla Estado estable Es. En otras palabras, el primer shell es 2, el siguiente shell es 8 y el siguiente shell también es 8 ... Solo así se encuentra en un estado estable.

Regla del octeto y propiedades del oxígeno activo: caso del átomo de hidrógeno
Por ejemplo, un átomo de hidrógeno con número atómico 1 tiene 1 electrón. Esto no es estable según las reglas del octeto. Y necesita 1 electrón para estabilizarse. Entonces, se estabiliza tomando un electrón de los átomos circundantes.

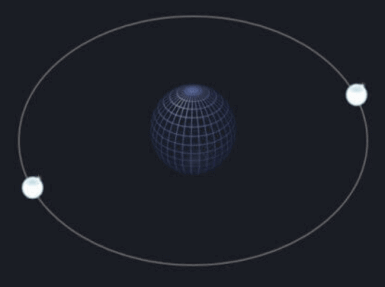
En este caso, el núcleo de hidrógeno tiene una carga de +1, pero como hay dos electrones, la carga de -2 se convierte en +1 - 2 = -1. (El núcleo tiene una carga de +1 y el electrón tiene una carga de -1) Entonces -1 es Anión de hidrógeno Esto va a ser. Este anión de hidrógeno -1 es estable porque tiene dos electrones de acuerdo con la regla del octeto, por lo que puede existir como es en la naturaleza. (Tenga en cuenta los 'dos primeros' en la imagen de arriba)
Regla del octeto y propiedades del oxígeno activo: caja del átomo de helio
A continuación, el helio, número atómico 2, tiene dos electrones. Por lo tanto, dado que sigue la regla del octeto, puede existir en la naturaleza de manera estable como un átomo puro. (Tenga en cuenta los 'dos primeros' en la imagen de arriba)
Regla del octeto y propiedades del oxígeno activo: ejemplos de átomos de oxígeno
A continuación, el número atómico de oxígeno es 8. De acuerdo con la regla del octeto, se deben descartar 6 electrones para convertirse en 2 electrones o se deben obtener 2 electrones para que se estabilicen 10 electrones.
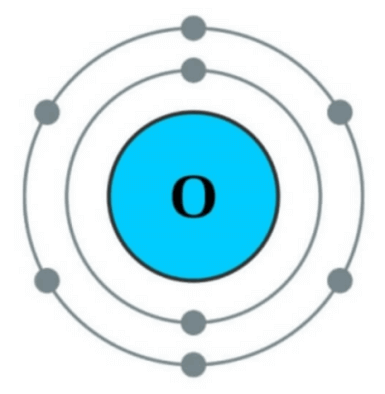
En este caso, es más fácil obtener 2 electrones que descartar 6 electrones. Entonces 8 electrones Átomo de oxígeno puro Es golpeado al intentar robar dos electrones escasos de los átomos circundantes. Se dice que estos átomos de oxígeno puro son altamente reactivos Oxígeno activo Se llama.
En este caso, el núcleo atómico de oxígeno tiene una carga de +8, pero como hay 10 electrones, la carga de -10 se convierte en +8 - 10 = -2. (El núcleo tiene una carga de +1, el electrón tiene una carga de -1) Entonces, -2 es Anión de oxígeno Esto va a ser. Este anión de oxígeno -divalente es estable porque tiene 10 electrones según la regla del octeto, por lo que puede existir tal como es en la naturaleza. (Tenga en cuenta que los siguientes 2 + 8 = 10 elementos en la imagen de arriba)
Terminado
Como antes, hemos examinado las propiedades del oxígeno activo con la regla del octeto. Para existir en la naturaleza, debe estar en un estado estable. El átomo de hidrógeno puro y el átomo de oxígeno puro no se encuentran en un estado estable según la regla del octeto, por lo que toman electrones del entorno. Entonces se convierte en un anión de hidrógeno y un anión de oxígeno. Por otro lado, los átomos de helio puro se encuentran en un estado estable de acuerdo con la regla del octeto, por lo que no es necesario tomar electrones del entorno. En conclusión, lo que existe en estado estable en la naturaleza Anión de hidrógeno Anión de oxígeno Átomo de helio puro Puedes ver que lo es.
Átomo de hidrógeno y anión de hidrógeno, átomo de oxígeno y anión de oxígeno. Solo el número de electrones era diferente, ¡pero eran iguales! En el próximo artículo, Iones negativos Echemos un vistazo.
Gracias por suscribirte hasta ahora. Yo era Mondol ~ ^^


Dejar un comentario